2017年10月9日欧洲药物管理局(EMA)和欧盟委员会(EC)更新了关于人类使用药用产品的标签和包装说明书中辅料指南的附件。本次更新的附件包括五种新辅料和十种现有辅料的新安全警告。笔者汇总了更新部分的辅料信息,与读者分享。
作者语
2017年10月9日欧洲药物管理局(EMA)和欧盟委员会(EC)更新了关于人类使用药用产品的标签和包装说明书中辅料指南的附件。本次更新的附件包括五种新辅料和十种现有辅料的新安全警告。笔者汇总了更新部分的辅料信息,与读者分享。
2017年10月9日欧洲药物管理局(EMA)和欧盟委员会(EC)更新了关于人类使用药用产品的标签和包装说明书中辅料指南的附件。本次更新的附件包括五种新辅料和十种现有辅料的新安全警告。笔者汇总了更新部分的辅料信息,与读者分享。
一、EMA辅料指南更新的基本问题
1、更新的目的是什么?
辅料是指药物中活性成分以外的所有物质。虽然大多数辅料被认为是非活性的,但在某些情况下,某些辅料可能具有已知的作用或在某些情况下发挥作用。因此EMA规定这些辅料必须在药物标签中声明,以便安全使用。
更新附件中包含的所有辅料必须在药品标签、包装说明书和安全警告中声明。
此次更新的主要目的是考虑现有指南附件中尚未解决的安全问题。此次更新还特别关注这些辅料用于儿童或孕妇时的安全性。
2、更新了哪些内容?
本次更新的附件包括五种新辅料和十种现有辅料的新安全警告。新的安全信息将有助于患者和医护人员在他们使用和开具处方药物时做出更加正确的决定。
3、更新后的辅料指南如何实施?
修订的附件适用于EMA及其各成员国批准的药品。
(1)对于新药上市申请,修订的附件将从发布之日起生效,申请人必须在标签中实施信息;
(2)对于已上市药品,药品持有人应该利用第一次机会按照修订后的附件来执行信息;
(3)对于不可预见的监管提交药品,药品持有人应在修订附件发布后的三年内提交IB类型变更。
二、EMA辅料指南附件表格项目的说明
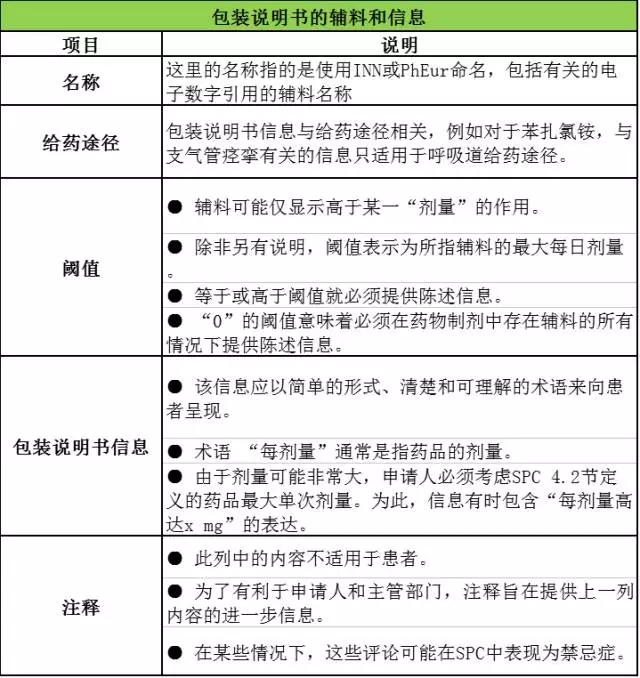
EMA辅料指南附件《包装说明书的辅料和信息》是由名称、给药途径、阈值、包装说明书和注释这五项内容组成,下面通过表格,对这五项内容逐一解释说明。
三、EMA辅料指南附件中新增的15种辅料及其相关信息
包装说明书中新增的15种辅料及其相关信息



- 地方医保增补目录独家品种过半—医保目录合理性评价
- 新华网专访石远平:为医药插上大数据之翼,引领产业腾飞
- 【重磅】大道破局,革新创制丨2019第四届中国医药研发·创新峰会迎风起航
- 【重磅】汇智新时代,赋能新征程丨2019中国医药健康产业发展大会暨第四届中国医药研发•创新峰会(PDI大会)盛大开幕
- 【PDI】最全参会攻略出炉,请及时领取!
- 【盘点】凝血酶抑制剂~3大品种及市场情况
- 【独家】中国制药行业整体如何?最底层一线人员是重要缩影!
- 【热点】解读山东打响药品新招标第一枪的背景及关键点
- 【独家】知识产权保卫战:礼来20亿美元品种,防守成功!
- 【独家】揭晓上市药企销售毛利率TOP10,9家超90%,这些产品最赚钱...















